www.joiiup.com
益生菌防治COVID-19的醫學論證
iOS 點我下載
Android 點我下載

針對COVID-19的醫療介入措施,包含疫苗施打陸續進行中,但何時能大規模普及,尚未有定論。再加上變種病毒的爆發,疫苗施打的預防成效如何仍存在大的變數。因此,有必要採取更多的預防措施。
幸運的是,身體有自己的防禦系統:免疫系統,而益生菌可以增強這種複雜網絡抵禦冠狀病毒等感染的能力。

益生菌為對抗COVID-19新方向
益生菌能平衡腸道微生態,有望增強免疫力對抗病毒及細菌,因此成為對抗COVID-19新方向。補充益生菌是最快且最安全有效增加體內有益菌數量的辦法,由於腸道微生物群包含許多不同類型的微生物,每個群組負責不同的工作。近期,國際醫學專家發現抗COVID-19的益生菌種,發表許多新的研究與臨床報告。由COVID-19引起的多種症狀,包括肺炎、嚴重的呼吸道感染和身體器官衰竭已經確認。
因此,在SARS-CoV-2的傳播中,空氣飛沫是主要來源,胃腸道也可能參與冠狀病毒的發病病因。在病人的腸道和糞便樣本以及污水管道中也發現了SARS-CoV-2的RNA。
SARS-CoV-2可以感染腸道吸收性細胞,從而充當COVID-19 [1]的載體。來自大量的臨床數據已表明,腸道感染在冠狀病毒中很常見,並且加劇了疾病的嚴重性。益生菌是至關重要的微生物,當以足夠的劑量食用時,它們可以對宿主產生有益的作用。
醫學數據表明,特定的益生菌菌株有助於預防病毒和細菌感染,例如敗血症,腸胃炎和呼吸道症候群 [2]。
益生菌對病毒性呼吸道感染的影響機制
益生菌可以控制與藥物有關的腹瀉和胃腸道感染,並控制其他感染部位,例如呼吸道感染和敗血症。病毒是引起上呼吸道感染的主要因素,在預防上呼吸道感染中,已經確認了益生菌的有益作用,對13項隨機對照試驗進行了多項研究,其中包括 4,230 名接受益生菌治療的年輕人和兒童 [3];參與者的上下呼吸道感染的風險降低了2倍,值得注意的是即使感染了,病情嚴重程度明顯降低了。
此外,還有一項隨機雙盲的安慰劑對照研究,研究對象為 523 名年輕人,他們服用了加氏乳桿菌(Lactobacillus gasseri) PA 16/8,長雙歧桿菌(Bifidobacterium longum) SP 07/3和兩歧雙歧桿菌(Bifidobacterium bifidum) MF 20/5,並添加了一些礦物質和維生素,結果表明,流感發作時間較短,發燒天數也減少了 [4]。
短乳桿菌(Lactobacillus brevis)在對 1,692 名學童的研究中也顯示出令人鼓舞的結果,並大大減少了流感呼吸道感染的發生 [5]。
因此,可以得出結論:益生菌具有對減緩冠狀病毒爆發事件作出有效貢獻。

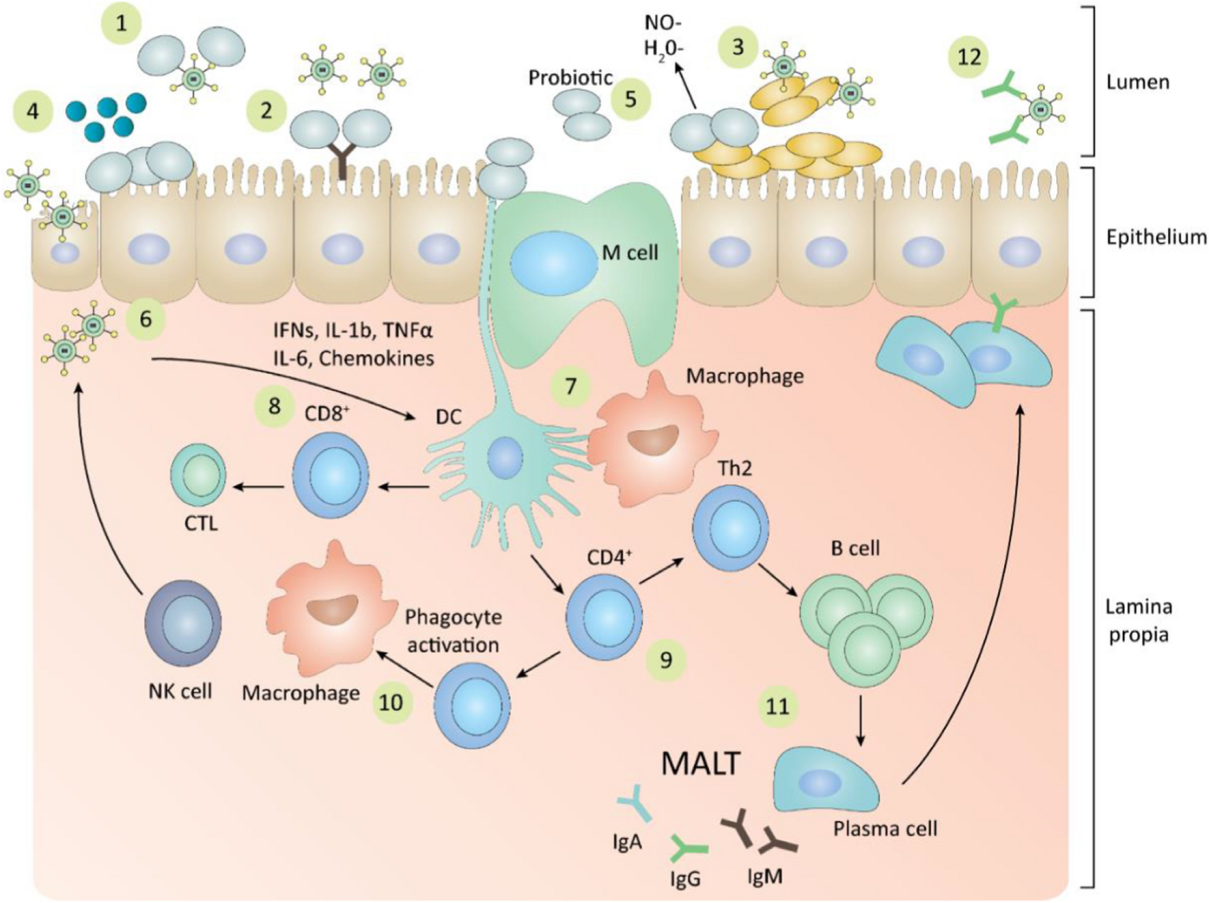
總體而言,針對益生菌對病毒性呼吸道感染的影響,以下的機制被提出(圖一)[6]:
- 誘捕策略的直接效果
- 由白介素、NK細胞、Th1和IgA(免疫球蛋白A)產生免疫反應的活化
- 誘導黏膜保護(腸粘蛋白可能附著在病毒上並抑制病毒複製)
- 生產抗病毒成分,例如細菌素和過氧化氫(H2O2)
- 宿主細胞誘導低水平一氧化氮(NO)生成和脫氫酶(dehydrogenase)形成
- 免疫細胞的免疫調節(例如巨噬細胞和樹突狀細胞[DCs])
- 誘導CD8+ T細胞分化為CTLs,殺死被感染的細胞
- CD4+ T細胞分化為Th1和Th2細胞(以及Th2細胞誘導B細胞)
圖一、益生菌在呼吸道病毒感染期間的抗病毒作用 [6]
MALT(與黏膜相關的淋巴組織);NK細胞(自然殺傷細胞);CTL(細胞毒性T淋巴細胞);Th1(T助手1);Th2(T助手2);DC(樹突狀細胞);M細胞 (微折疊細胞);IgM,(免疫球蛋白M);IgG(免疫球蛋白G);IgA(免疫球蛋白A);interferons (干擾素A);IL-1b(白介素1 beta);TNF-α(腫瘤壞死因子α);IL-6(白介素6);NO(一氧化氮)
益生菌幫助減少細菌感染
除用於病毒感染外,益生菌還可以幫助減少細菌感染,例如成人下呼吸道感染,從包含2,000名的肺炎感染病人的隨機對照試驗中獲得了許多實驗數據。在這項研究中,來自1,800多名成年人的結果表明事件的發生率降低 [7]。
正如來自中國的研究表明的那樣,COVID-19可能伴隨腸道菌群失衡,從而引起嚴重的感染,通過益生菌菌株可以幫助腸道恢復穩態。
腸道菌群對宿主的免疫反應具有系統性影響,並且對附近黏膜部位(如肺部)的免疫反應也有重要影響。食用特定的雙歧桿菌 (Bifidobacterial)和乳酸桿菌 (Lactobacilli)菌株可對從呼吸道清除流感病毒產生積極影響。
某些益生菌菌株具有增強的I型干擾素 (interferon)水平,從而提高了抗原呈現細胞 (antigen-presenting cells),自然殺手細胞和T細胞的數量和功能,並增加了全身和黏膜部位特定抗體的水平[8]。
有證據表明,益生菌菌株可以改善促發炎和允許清除病毒免疫調節細胞因子之間的穩定性,其最適合避免急性呼吸窘迫症候群,這是COVID-19的主要症狀。一個包含青少年隨機對照設計,使用乳酸桿菌DR7 抑制血漿促發炎細胞因子(如IFN-γ和TNF-α);另一項關於年輕人的試驗表明,抗炎細胞因子(如IL-4和IL-10)得到了改善,漿細胞的過氧化和氧化壓力水平降低了 [9]。COVID-19的病人可能會出現某些細胞因子風暴,這種調節功能非常重要。
口服食用益生菌菌株的方法將有助於腸道免疫反應的出現,這是宿主防禦的關鍵所在:已知益生菌菌株可改善緊密連接(tight junctions)的牢固性。
例如,它們可以作為結腸細胞的燃料,通過增加丁酸鹽的含量來暫時減少SARS-CoV-2的侵襲。如醫學實驗研究所示,益生菌菌株還被證明具有抗病毒活性 [10]。
疫苗是預防病毒感染性疾病的有前途的治療方法。然而,如流感病毒所觀察到的,它們的功效可能受到RNA病毒突變的限制 [11,12]。這增加了感染的風險,由於經常性的廣泛爆發,使這些病毒嚴重威脅公共健康。人類胃腸道、肺、皮膚和口腔中的微生物群落(細菌、真菌、古細菌、病毒和原生動物)與宿主細胞成片利共生(commensal relationship)關係,從而在人類健康中發揮重要作用[1]。
腸胃道內存在的共生細菌(1×10¹³ CFU)等於人類細胞的數量 [2],這種定殖在出生後不久就開始,並且它們的概況和數量在1歲時穩定下來,有 1000 多種細菌 [13, 14]。
腸胃道微生物群具有與人類細胞(包括特定免疫細胞)相互作用的能力
這些相互作用在宿主中產生不同的健康益處,包括:
- 調節胃腸動力
- 活化和破壞毒素、基因毒素、誘變劑
- 轉化膽汁酸和類固醇
- 生產維生素
- 吸收礦物質
- 代謝異源物質
- 影響腸道通透性和屏障功能
- 調節黏膜和全身免疫
- 對皮膚和上呼吸道的有益作用 [14, 15]
微生物群主要通過上呼吸道或沿著黏膜表面的擴散而散佈在肺中 [3, 16]。這些有益的微生物與在不同器官中人體細胞定殖的病原體競爭,從而促進宿主健康。這需要大量有益的微生物,並且該系統的任何不平衡或破壞都可能導致腸道菌叢失衡(Dysbiosis),這會使病原體引起疾病,例如呼吸道感染 [11,17]。長期使用抗生素也可能導致腸道菌叢失衡。
因此,通常還建議近期使用抗生素治療任何疾病的病人服用益生菌。人胃腸道中腸道菌叢失衡的其他原因包括暴露於毒素、壓力、疾病、飲食不足和年齡[14]。
腸-肺軸(gut-lung axis)與COVID-19
腸胃道和肺是容納微生物群的身體包廂,但是與腸道 [18]相比,肺中的微生物群較少。越來越多的證據表明,腸與肺之間存在雙向通訊,稱為腸-肺軸(gut-lung axis)。這種雙向串擾(crosstalk)涉及免疫穩態的支持[19],據信腸胃道發炎通過這種連接導致肺部發炎 [20]。這種發炎從腸道向肺轉移的確切機制尚未完全揭示。
然而,腸道和肺微生物群的菌叢失衡是關聯因素之一。先前已證明腸道菌叢失衡與幾種呼吸道疾病相關 [20, 21],並且在幾種呼吸系統疾病 [18, 22]中已觀察到肺部菌群向腸道菌群的遷移。肺與腸道菌群系統之間雙向相互作用背後的機制之一,是腸胃道通透性的提高允許腸道菌群向肺部洩漏和遷移,從而調節其菌群與免疫反應 [18]。此外,腸微生物雙向成分還包括腸道微生物成分和代謝產物,如脂多醣(LPS)和短鏈脂肪酸(SCFA)。
此外,從腸胃道到肺的免疫細胞或發炎介質的血液或淋巴介質介導的循環可導致肺部發炎反應 [18, 23]。

除了最常見的呼吸道症狀(例如由COVID-19感染引起的發燒,咳嗽和嚴重呼吸道症候群)外,據報導病人還表現出胃腸道症狀,包括腹瀉,嘔吐,噁心,食慾不振,胃腸道出血和腹痛 [24]。
發現有腸胃道症狀(例如腹瀉)的COVID-19病人比沒有胃腸道症狀的病人更易發生更嚴重的呼吸系統疾病 [25]。儘管腸道對肺部健康的影響已得到充分證實,但是關於肺部對腸道健康的相反作用的可用知識仍然很少。
因此,為什麼COVID-19會影響腸胃道的完整性尚未清楚,但腸道菌叢失衡可能是其促成機制之一。急性肺損傷介導的肺功能障礙與血液介導的腸道菌群的調節相關 [26, 27],在肺部過敏的情況下,腸道菌群的數量也受到調節 [28]。結果,COVID-19可能誘導肺微生物群破壞,從而改變腸胃道微生物群,導致腸胃道症狀。
研究表明,感染COVID-19的病人產生的胃腸道症狀,可能歸因於免疫反應引起的組織和器官受損 [29]。另外,血管收縮素轉換酶2(ACE2)是COVID-19 [30, 31]的主要宿主細胞受體。ACE-I和ACE-II是至關重要的酶,它們通過生化腎素-血管收縮素-醛固酮系統(RAAS)途徑在調節血壓中發揮重要作用 [32]。
除了肺部以外,ACE2還通過腸表達,並且腸道ACE2受體通過病毒的直接定殖可能是導致與COVID-19相關的胃腸道症狀的原因。取而代之的是,由呼吸道感染引起的腸道細胞凋亡途徑的功能障礙 [33]是與COVID-19相關的胃腸道症狀的另一種解釋。此外,由於腸胃道和呼吸道具有相同的胚胎起源,仍可能導致COVID-19相關的腸胃道症狀,因此它們在生理和病理條件下結構相似且相互作用類似。所有這些建議的機制都可以單獨或共同作用,以誘發與COVID-19相關的胃腸道干擾。
延伸閱讀
減肥需知:腸道菌如何影響代謝系統
益生菌是活的微生物,當給予足夠的劑量時,它們可以對宿主產生有益的生理作用
在各種發酵食品(例如優酪乳,奶酪和泡菜)中發現的一些乳酸菌由於對健康有益,因此通常被認為是安全的,並被歸類為益生菌 [34]。有建議認為,益生菌應該每天以10⁸-10¹⁰CFU的劑量食用,以對人體產生健康益處。
被證實的健康好處包括:
- 通過改善乳糖消化
- 抑制過敏性疾病的發作
- 維持腸道pH值
- 預防或治療缺血性心臟病
- 減少血液中的膽固醇水平
- 產生維生素B
- 提高飲食中鈣的生物利用度
- 減少乳糖不耐症的症狀
- 增強免疫活性
益生菌已顯示具有許多有益的免疫和健康作用,它們不僅提高了營養的生物利用度和適度的健康,而且還參與調節細菌生態系統和調控免疫細胞(modulate immune cells) [35]。
樹突狀細胞(DC)在健康腸道的免疫穩態中起關鍵作用
DC是關鍵的抗原呈遞細胞,其吸收抗原(即病毒、癌症),並在其表面呈遞小的抗原性肽,以引發T細胞趨向促炎(Th1)或抗炎(Th2)表型。處於未成熟狀態的DC可能導致T細胞缺失或刺激調節性T細胞[36]。腸道菌群能夠驅動DC啟動這些細胞,實際上,羅伊氏乳桿菌(L. reuteri) 和乾酪乳桿菌(L. casei)可刺激IFN-γ的產生並活化促炎性Th1細胞 [37]。同樣,在小鼠中口服嬰兒雙歧桿菌(B. infantis) 會刺激DC,DC抑制Th2偏向反應 [38],並刺激消除病毒所需的Th1促炎反應。

單核細胞存在於外周血中,是最早與細菌和病毒接觸的細胞之一
它們分化為組織巨噬細胞,在那裡腸道菌群或攝入的益生菌與之相互作用以分泌多種細胞因子。促炎性細胞因子IL-12由巨噬細胞分泌,巨噬細胞刺激自然殺傷細胞和CD4 + Th1細胞分泌消除病毒所需的IFN-γ [39]。另外,加氏乳桿菌,雙歧桿菌 ,嗜酸乳桿菌(L. acidophilus)菌株誘導單核細胞產生IFN-α [39]。益生菌副乾酪乳桿菌(L. paracasei) DG增加人單核細胞系THP-1 [40]的TNF-α,IL-6,IL-8。同樣,最近注意到嗜熱鏈球菌(S. thermophilus)誘導了TNF-α,IL-6,IL-8,這是抗病毒作用所必需的 [41]。NK細胞在抵抗病毒感染的早期免疫反應中很重要,尤其是通過清除病毒感染的細胞。乳酸桿菌益生菌菌株能夠刺激DC分泌IL-12,繼而活化NK細胞分泌IFN-γ,IFN-γ是肺部細菌(金黃色葡萄球菌)和病毒消除的必需細胞因子 [37,42]。
益生菌,如乾酪乳桿菌也可以與上皮細胞上的類鐸受體(Toll-like receptors, TLR)相互作用,增強細胞因子的產生,這些細胞因子在提高上皮細胞的生產力和防止其凋亡方面發揮著重要作用,從而增強它們的生存和增殖恢復期間 [43,44]。了解免疫細胞活化、細胞因子濃度和免疫調節至關重要,這為處理病毒感染提供了清晰的途徑。
疫苗、抗生素和抗病毒藥物已定期用於預防和治療細菌或病毒感染性疾病;但是,大多數感染的控制尚未完全實現。在許多病原性細菌,病毒,寄生蟲和真菌中,抗菌素的耐藥性逐漸出現 [45]。
不推薦使用抗生素治療病毒感染,因為它們對病毒沒有活性並且破壞了正常的人類微生物群。因此,已經開發出其他方法來治療和預防細菌或病毒性呼吸道感染。這些方式包括噬菌體、抗菌肽和益生菌 [46]。益生菌對多種病原體表現出有效的抗菌活性。在過去的二十年中,已提出益生菌作為抗病毒劑,以對抗引發呼吸道感染的病毒 [46]。

有多種可能的作用機制支持益生菌能抑制呼吸道病毒的活性。然而,最可能的機制是先天免疫系統的調節和獲得性免疫應答的增強 [47]。根據對不同病毒感染的先前研究,很明顯,可以通過食用健康、均衡的飲食和使用管控的補充劑,例如維生素、礦物質、纖維和益生菌 [46]。
數項研究表明,益生菌可通過活化免疫球蛋白A(IgA)分泌並增強派爾集合淋巴集結(Peyer' s plaques)、嗜中性粒細胞、巨噬細胞、自然殺傷細胞、腸系膜淋巴結和上皮內淋巴細胞 [48]。
口服益生菌菌株已用於通過最小化感染症狀,縮短感染持續時間,減少肺部或鼻腔沖洗液中的病毒水平,產生抗病毒劑來預防或治療由甲型流感、H1N1流感和呼吸道合胞病毒引起的感染。通過減少感染過程中的體重損失來提高人體免疫力,增強免疫活性並增強健康 [49, 50]。
含有副乾酪乳桿菌,乾酪乳桿菌和發酵乳桿菌(L. fermentum) 的益生菌補品可顯著降低成人感冒樣症狀和上呼吸道感染的發生率,這些成年人通常每年感冒≥4次。
與未治療的成年人或他們自己的基線結果相比,治療的成年人的血清中干擾素(IFN)-γ水平顯著更高,而胃腸道中的可溶性IgA水平更高。
益生菌可能是ACE受體的潛在阻礙劑
除口服益生菌外,使用鼻噴霧劑和霧化製劑經鼻內給藥被認為是一種有效且非侵入性的方法,可將益生菌分配到肺部細胞中以調節微生物群並治療或預防多種病毒感染 [51]。幾種益生菌種類,包括短桿菌(B. breve)、戊糖乳桿菌(L. pentosus)、乾酪乳桿菌、植物乳桿菌 (L. plantarum)、鼠李糖乳桿菌(L. rhamnosus)、保加利亞乳桿菌、加氏乳桿菌、羅伊氏乳桿菌、乳酸乳球菌(L. lactis)和短毛乳酸桿菌(L. brevis )已經使用在鼻內或口服給藥了 [47, 48]。
研究團隊 [50]發現,在鼻中注射鼠李糖乳桿菌在感染H1N1流感病毒的小鼠中,與對照小鼠相比,可顯著減輕症狀並提高存活率。研究指出說,治療的小鼠在肺部表現出更高的細胞毒性活性、白介素、腫瘤壞死因子和單核細胞趨化蛋白的mRNA表達升高。益生菌對ACE酶的直接或間接積極影響是眾所周知的[53]。在食品發酵過程中,益生菌產生的生物活性肽具有通過阻斷活性位點來抑制ACE酶的能力 [54, 55]。此外,死亡的益生菌細胞的碎片也可作為ACE抑制劑 [56]。這些發現表明,益生菌可能是ACE受體的潛在阻礙劑,ACE受體充當SARS-CoV-2攻擊腸胃道細胞的通道。有研究指出使用ACE阻礙劑可減少呼吸窘迫症候群的積極影響 [57]。

到目前為止,正在進行一些益生菌治療COVID-19病人的功效的臨床試驗研究 [58]。一些患有COVID-19的病人表現出腸道微生物功能障礙,其特徵是雙歧桿菌和乳桿菌等不同益生菌的數量很少。這可能是其免疫力弱的一個指標,因此,已建議這些病人需要營養支持和益生元或益生菌補充以使腸道菌群平衡重新正常化並降低感染風險 [59]。同時,病人的飲食習慣是腸胃道微生物群水平、多樣性、結構和功能的重要因素。
因此,應均衡飲食,包括含益生菌的食物和增強免疫力的微量營養素,例如多酚;維生素A,C和D;礦物質(主要是硒和鋅)可以減輕COVID-19感染的風險 [60]。
益生菌的食品來源(例如發酵產品)具有預防COVID-19的良好潛力。在先前的研究中,食用含有益生菌菌株的發酵乳可顯著降低健康嬰兒,兒童,成人和老年人中上呼吸道感染的發生率 [61, 62]。
益生菌增強自然免疫力
鑑於先前有關於預防和治療幾種病毒感染的益生菌潛在應用的報導,補充益生菌顯然是一種合適的策略。儘管缺乏確鑿的證據支持這些治療方法可以預防或治療這種傳染病,但這些觀察結果仍支持對COVID-19病人進行益生菌治療,在COVID-19感染之前、之中或之後使用益生菌來增強人群的自然免疫力是合理的。
先前的研究使用了大量益生菌物種和菌株,它們的免疫調節作用是菌株特異性的 [63]。在乳酸桿菌菌株之間,針對流感病毒感染的保護作用差異很大 [64]。
因此,必須根據動物和人體研究選擇有效的益生菌菌株。
關於所需數量的益生菌,必須以足夠的數量(> 7 log CFU)攝入,以對包括COVID-19在內的呼吸道感染具有保護和治療作用。微膠囊化應用於保護益生菌免於受惡劣條件的影響,使其在腸道內的附著位點以足夠的水平積聚。
與益生菌在疾病預防或治療(例如COVID-19)中的有益作用相關的其他因素,包括在疾病背景下的給藥時間,益生菌的劑量,治療持續時間以及宿主的健康狀況和微生物群狀況。考慮到這些因素的臨床試驗應在不久的將來啟動。
腸胃道微生物的數量和生物多樣性通常隨著年齡和抗生素治療而減少已經被證實。這種營養不良與多種傳染性、代謝性或發炎性疾病和狀況顯著相關,例如營養不良、結腸癌、肥胖症、糖尿病和動脈粥樣硬化 [65]。菌群失調的病人和老年人最容易感染COVID-19。因此,在那些組中補充益生菌可能會改善胃腸道微生物群調節免疫活性的能力,進而預防包括COVID-19在內的病毒感染。
在一項對52項已發表的研究進行綜合分析的研究中,研究了益生菌預防或治療多種疾病的能力,在包括急性呼吸道感染在內的五種疾病中,觀察到了最有效的益生菌證據 [66]。此外,在一項涉及6269名兒童的23項隨機對照試驗的綜合分析中,研究了益生菌對呼吸道感染的影響。結果表明,食用益生菌可以顯著降低感染兒童症狀的嚴重程度和感染持續時間[67]。需要進行進一步研究以確定健康或感染動物模型中益生菌對包括SARS-CoV-2在內的冠狀病毒的準確作用機制。
這些研究可以使人們更好地了解胃腸道中的細菌動力學。動物或人類研究可用於通過靶向在肺部的病原體評估鼻內益生菌的直接作用,以及通過調節免疫活性而產生的間接作用。這些研究可能有助於治療病毒感染,例如COVID-19。

益生菌對健康的影響歸因於各種活動,包括它們支持腸道完整性和維護腸道通透性的能力,與病原體競爭營養和附著位點,調節免疫細胞活性以抵禦入侵的病原體以及預防過度免疫反應和發炎。
延伸閱讀
腸腦軸:腸道菌叢失衡對免疫力與腦部(失智)疾病的影響-兼論益生菌的功效
結論
約有八成的免疫細胞位於腸道內,而有越來越多證據指出,健康、豐富、多樣的微生物群能協助免疫系統有效抵禦內在(如變異細胞)及外來威脅(病毒與感染)。益生菌可以與腸道微生物組相互作用,以增強免疫系統,增強免疫反應並誘導適當的免疫信號通路。
已經證實了幾種益生菌可以減少細菌或病毒感染的持續時間 [68,69]。免疫適應性可能是可以加強針對病毒感染的保護的方法之一。通常,在對抗病毒感染方面,預防比治療更有效。因此,益生菌已經成為控制這些感染的合適候選者。
益生菌是活的微生物,當攝入足夠量時會對健康有實質好處,包括增強的免疫活性和清除呼吸道感染。益生菌可以降低疾病的發生率和嚴重程度,表明它們有望用於治療或預防COVID-19。益生菌可以通過維持人的胃腸道或肺微生物群來幫助預防COVID-19,因為營養不良在人們對傳染病的易感性中起主要作用。在COVID-19大流行期間,任何具有誘導黏膜和全身反應能力的方法都可能有用。益生菌的益處是菌株特異性的,因此必須確認是科學證實為有益的細菌菌株。
參考資料
[1] https://pubmed.ncbi.nlm.nih.gov/31994742/
[2] https://pubmed.ncbi.nlm.nih.gov/32241899/
[3] https://pubmed.ncbi.nlm.nih.gov/32130898/
[4] https://pubmed.ncbi.nlm.nih.gov/32019667/
[5] https://pubmed.ncbi.nlm.nih.gov/15306396/
[6] https://pubmed.ncbi.nlm.nih.gov/33745067/
[7] https://pubmed.ncbi.nlm.nih.gov/28591308/
[8] https://pubmed.ncbi.nlm.nih.gov/18986600/
[9] https://pubmed.ncbi.nlm.nih.gov/32255312/
[10] https://pubmed.ncbi.nlm.nih.gov/27836128/
[11] https://pubmed.ncbi.nlm.nih.gov/32075727/
[12] https://pubsonline.informs.org/doi/10.1287/opre.2018.1817
[13] https://pubmed.ncbi.nlm.nih.gov/24861948/
[14] https://pubmed.ncbi.nlm.nih.gov/25849657/
[15] https://pubmed.ncbi.nlm.nih.gov/30202268/
[16] https://mbio.asm.org/content/8/1/e02287-16
[17] https://pubmed.ncbi.nlm.nih.gov/31773556/
[18] https://jpnim.com/index.php/jpnim/article/view/090139
[19] Dang, A. T. & Marsland, B. J. Microbes, metabolites, and the gut–lung axis. Mucos. Immunol. 12, 843–850 (2019).
[20] https://pubmed.ncbi.nlm.nih.gov/32072252/
[21] https://pubmed.ncbi.nlm.nih.gov/24187454/
[22] https://pubmed.ncbi.nlm.nih.gov/29955219/
[23] Otani, S. & Coopersmith, C. M. Gut integrity in critical illness. J. Intens. Care 7, 17. (2019).
[24] https://pubmed.ncbi.nlm.nih.gov/32406522/
[25] https://pubmed.ncbi.nlm.nih.gov/32304638/
[26] https://pubmed.ncbi.nlm.nih.gov/25333938/
[27] https://pubmed.ncbi.nlm.nih.gov/27781554/
[28] https://pubmed.ncbi.nlm.nih.gov/26090504/
[29] https://pubmed.ncbi.nlm.nih.gov/32222988/
[30] https://pubmed.ncbi.nlm.nih.gov/32457035/
[31] https://pubmed.ncbi.nlm.nih.gov/32391299/
[32] Te Riet, et al., J. Hypertension: renin-angiotensin-aldosterone system alterations. Circ. Res. 116, 960–975 (2015).
[33] https://pubmed.ncbi.nlm.nih.gov/22592747/
[34] FAO/WHO. Guidelines for the Evaluation of Probiotics in Food. https://www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf (2002).
[35] https://pubmed.ncbi.nlm.nih.gov/30502748/
[36] https://pubmed.ncbi.nlm.nih.gov/17375199/
[37] https://pubmed.ncbi.nlm.nih.gov/21680065/
[38] https://pubmed.ncbi.nlm.nih.gov/29176981/
[39] https://pubmed.ncbi.nlm.nih.gov/8076807/
[40] https://pubmed.ncbi.nlm.nih.gov/27913418/
[41] https://pubmed.ncbi.nlm.nih.gov/32045425/
[42] https://pubmed.ncbi.nlm.nih.gov/21178015/
[43] https://pubmed.ncbi.nlm.nih.gov/18005362/
[44] Zendeboodi, F., Khorshidian, N., Mortazavian, A. M. & da Cruz, A. G. Probiotic: conceptualization from a new approach. Cur. Opin. Food Sci. 32, 103–123 (2020).
[45] Olaimat, A. N. et al. Emergence of antibiotic resistance in Listeria monocytogenes isolated from food products: a comprehensive review. Compr. Rev. Food Sci. Food Saf. 17, 1277–1292 (2018).
[46] Al Kassaa, I. New Insights on Antiviral Probiotics: From Research to Applications (Springer, 2016).
[47] https://pubmed.ncbi.nlm.nih.gov/24638909/
[48] Khan, R., Petersen, F. C. & Shekhar, S. Commensal bacteria: an emerging player in defense against respiratory pathogens. Front. Immunol. 10, 1–9 (2019).
[49] https://pubmed.ncbi.nlm.nih.gov/23838113/
[50] https://pubmed.ncbi.nlm.nih.gov/23594927/
[51] https://pubmed.ncbi.nlm.nih.gov/11329464/
[52] https://pubmed.ncbi.nlm.nih.gov/18005362/
[53] https://pubmed.ncbi.nlm.nih.gov/28315049/
[54] https://pubmed.ncbi.nlm.nih.gov/22916878/
[55] https://pubmed.ncbi.nlm.nih.gov/32161912/
[56] Miremadi, F., Ayyash, M., Sherkat, F. & Stojanovska, L. Cholesterol reduction mechanisms and fatty acid composition of cellular membranes of probiotic Lactobacilli and Bifidobacteria. J. Funct. Foods 9, 295–305 (2014).
[57] https://pubmed.ncbi.nlm.nih.gov/16001071/
[58] https://pubmed.ncbi.nlm.nih.gov/7352781/
[59] https://pubmed.ncbi.nlm.nih.gov/32391658/
[60] https://pubmed.ncbi.nlm.nih.gov/32276137/
[61] https://pubmed.ncbi.nlm.nih.gov/26419583/
[62] https://pubmed.ncbi.nlm.nih.gov/20863419/
[63] Wu, D., Lewis, E. D., Pae, M. & Meydani, S. N. Nutritional modulation of immune function: analysis of evidence, mechanisms, and clinical relevance. Front. Immunol. 10, 1–19 (2019).
[64] https://pubmed.ncbi.nlm.nih.gov/22120759/
[65] https://pubmed.ncbi.nlm.nih.gov/29109959/
[66] https://pubmed.ncbi.nlm.nih.gov/30248200/
[67] Wang, Y. et al. Probiotics for prevention and treatment of respiratory tract infections in children: a systematic review and meta-analysis of randomized controlled trials. Med. (Baltim.) 95, e4509, (2016).
[68] https://pubmed.ncbi.nlm.nih.gov/6974441/
[69] https://pubmed.ncbi.nlm.nih.gov/4006993/