www.joiiup.com
迎向健康老齡社會:解碼《Cell》2025 論文中的精準醫療藍圖
一、精準老化醫學的開場
全球人口老化已成為當代醫療體系前所未有的挑戰 [1]。隨著人類壽命的延長,與年齡相關的慢性疾病(如心血管疾病、神經退化性疾病、第二型糖尿病與癌症)也日益普遍 [2]。傳統醫學通常以零碎方式處理這些疾病,專注於某特定器官或在疾病出現後加以治療 [3]。
然而,此方法常忽略了同時導致多種疾病的根本生物機制。
越來越多研究認為「老化本身」正是這群慢性病共同的主要風險因子 [2]。因此,針對老化的根本成因進行干預,有望同時減輕多種疾病的負擔,不僅延長壽命,更延長「健康壽命」,換言之,即維持良好健康狀態的生活期。
為因應這項挑戰,「老年醫學科學(Geroscience)」應運而生,專注於探索驅動老化的基本生物機制 [5]。該領域的核心理念為「老年醫學假說(Geroscience Hypothesis)」,亦即透過針對這些基本老化機制進行干預,有可能延緩、預防或同時治療多種與老化相關的疾病與病症,從而延長健康壽命 [4]。
目前已有重大進展,科學家已逐步確認與描述這些老化的核心機制,並將其稱為「老化的標誌(hallmarks of aging)」 [7]。
這些基礎知識也催生了將基礎研究轉化為實際健康效益的努力。
由 Guido Kroemer 及其團隊於 2025 年發表在《Cell》期刊的綜論文章〈從老年科學到精準老化醫學:理解與管理老化 (From geroscience to precision geromedicine: Understanding and managing aging)〉,正值當前時代轉折點之際,成為一篇極具指標性的貢獻作品 [7]。
這篇論文(後稱 「本論文」)整合了目前對老化生物學的最新理解,並提出一個具有前瞻性的實踐框架—— 精準老化醫學(precision geromedicine),主張將此領域的知識以個人化、具針對性的方式應用於實際干預。
作為發表於高影響力期刊的重要論文,本論文的目的在於彌補基礎研究(老年科學, geroscience)與臨床應用(老化醫學, geromedicine)之間的鴻溝,同時可能重新定義並擴展傳統的老化標誌(hallmarks of aging),並提出具體可行的未來策略 [12]。
本論文所提出的「精準老化醫學」概念,以及老年科學作為一門正式領域的建立,象徵著該領域的重大轉折點
這項發展標誌著該領域正從基礎發現邁向強調健康壽命延伸(healthspan)的轉譯實踐階段 [10]。
這樣的觀點轉移,從治療單一疾病的模式,轉向將「老化」作為共同核心病因加以整體對應,可能代表醫學的一次典範轉移,而精準老化醫學正提供了這場轉型的實踐框架 [2]。
本文將對 Kroemer 等人於 2025 年發表的文章進行全面分析,內容涵蓋其主要目標、核心概念定義、探討的老化機制、提出的管理策略、老年醫學科學向精準老化醫學的轉變、研究結論與未來展望,並簡單介紹第一作者 Guido Kroemer 的背景與貢獻。
二、Guido Kroemer 簡介
了解第一作者 Guido Kroemer 的貢獻與專業背景,有助於我們掌握該篇《Cell》綜述文章的深度與聚焦方向。Kroemer 教授是當代生物醫學研究領域中極具聲望且影響力深遠的科學家,尤其以其在細胞死亡、自噬作用、粒線體功能、癌症生物學及老化研究上的開創性工作而廣為人知 [15]。
Guido Kroemer, M.D., Ph.D., PU-PH
Kroemer 的研究生涯中有多項突破性發現。
他最廣為人知的成就是證明粒線體膜的通透性改變是細胞凋亡(programmed cell death)的關鍵步驟之一。
他的實驗室深入解析粒線體介導細胞死亡的分子機制,揭示癌細胞如何藉由抑制這些路徑來存活。他亦發現了「誘導凋亡因子」(Apoptosis-Inducing Factor, AIF)蛋白,並釐清其在細胞凋亡中的角色。
此外,Kroemer 教授對「免疫原性細胞死亡」(Immunogenic Cell Death, ICD)也有重大貢獻。ICD 是一種可活化免疫系統的細胞死亡形式,與癌症治療與免疫監控密切相關。他的研究還涵蓋其他受調控的細胞死亡機制,例如壞死性凋亡(necroptosis)及自噬作用 [15]。
自噬作用是細胞清除與回收受損組件的關鍵機制,Kroemer 教授對其在細胞適應、壓力反應、免疫、癌症與老化中的角色進行了深入探究 [15]。他的團隊辨識出數種可調控自噬作用的內生代謝物(如Spermidine)與細胞外蛋白(如 DBI/ACBP),為未來療法開發提供可能靶點。由於粒線體在細胞死亡、代謝與訊號傳導中的核心角色,Kroemer 也被視為全球最具影響力的粒線體研究者之一 [15]。
在癌症研究方面,他亦涉足甚廣,涵蓋腫瘤代謝、腫瘤微環境、抗癌療法機制,以及免疫治療策略的開發 [15]。他對癌症與老化的相似性也提出關鍵性見解,特別是將癌症中的致)癌基因(oncogenes與抑癌基因(tumor suppressors)概念,延伸到老化領域中的「老化基因(gerogenes)」與「抗老化基因(gerosuppressors)」的構想,並於多篇論文中進行闡述 [23]。
Kroemer 教授亦為《Cell》於 2013 與 2023 年發表、對老化研究影響深遠的〈老化標誌(Hallmarks of Aging)〉系列綜述文章的共同作者 [13]。他的研究不僅關聯細胞死亡、自噬與代謝等基本機制,更進一步連結至老化過程與延長健康壽命的可能性 [17]。
他的學術職位與國際聲望亦可見一斑,目前擔任法國國家健康與醫學研究院(INSERM)、巴黎協和大學旗下的科德里耶研究中心(Centre de Recherche des Cordeliers)、Gustave Roussy 癌症中心、巴黎歐洲喬治蓬皮杜醫院的要職,並在瑞典卡羅林斯卡醫學院(Karolinska Institute)擔任兼任教授。他亦為多個國際頂尖科學學會成員,包括歐洲分子生物學組織(EMBO)、德國 Leopoldina 科學院、歐洲科學院、奧地利科學院等,並獲得多項重要學術獎項,例如歐盟的笛卡兒獎(Descartes Prize)[15]。
Kroemer 教授對細胞命運、代謝、壓力反應等分子與細胞層級的深入理解,使其在探討老化的過程中,展現出一種不同於傳統臨床老年醫學或流行病學取徑的「機制導向」觀點。也因此,他在 2025 年《Cell》文章中所提出的「精準老化醫學」構想,理所當然地以分子量測為基礎,強調對關鍵生物路徑的精準干預 [7]。
三、定義研究範式:老年醫學科學與精準老化醫學
Kroemer於 2025 年發表的這篇文章,運作於一個由「老年醫學科學(Geroscience)」與「精準老化醫學(Precision Geromedicine)」所構成的特定概念架構中。理解這兩個概念的含義,對於掌握本文的主軸與貢獻至關重要。
老年醫學科學(Geroscience)是一門專注於解析老化基本生物機制的科學,涵蓋分子、細胞與生理等不同層次[5]。其目的不僅是描述與年齡相關的變化,更重要的是找出驅動老化的核心因素,尤其是那些可操作的「老化標誌(actionable hallmarks)」[7]。其核心信念,即「老年醫學假說(Geroscience Hypothesis)」,主張只要能針對這些根本機制加以干預,就有可能延緩或預防整體老化過程,進而同時處理多項年齡相關的慢性疾病,而非在疾病發生後逐一應對 [2]。
在本論文中,「精準老化醫學(Precision Geromedicine)」被明確界定為老年科學(geroscience)原則的臨床應用與轉譯實踐 [10]。它象徵著老化機制的基礎研究,正式邁向在醫療實務中的應用階段。
精準老化醫學的核心目標是根據個體差異,個人化地制定策略以預防、阻截(即早期偵測與介入)與治療老年相關疾病,同時提升整體健康、體適能與老化過程中的身體韌性 [10]。
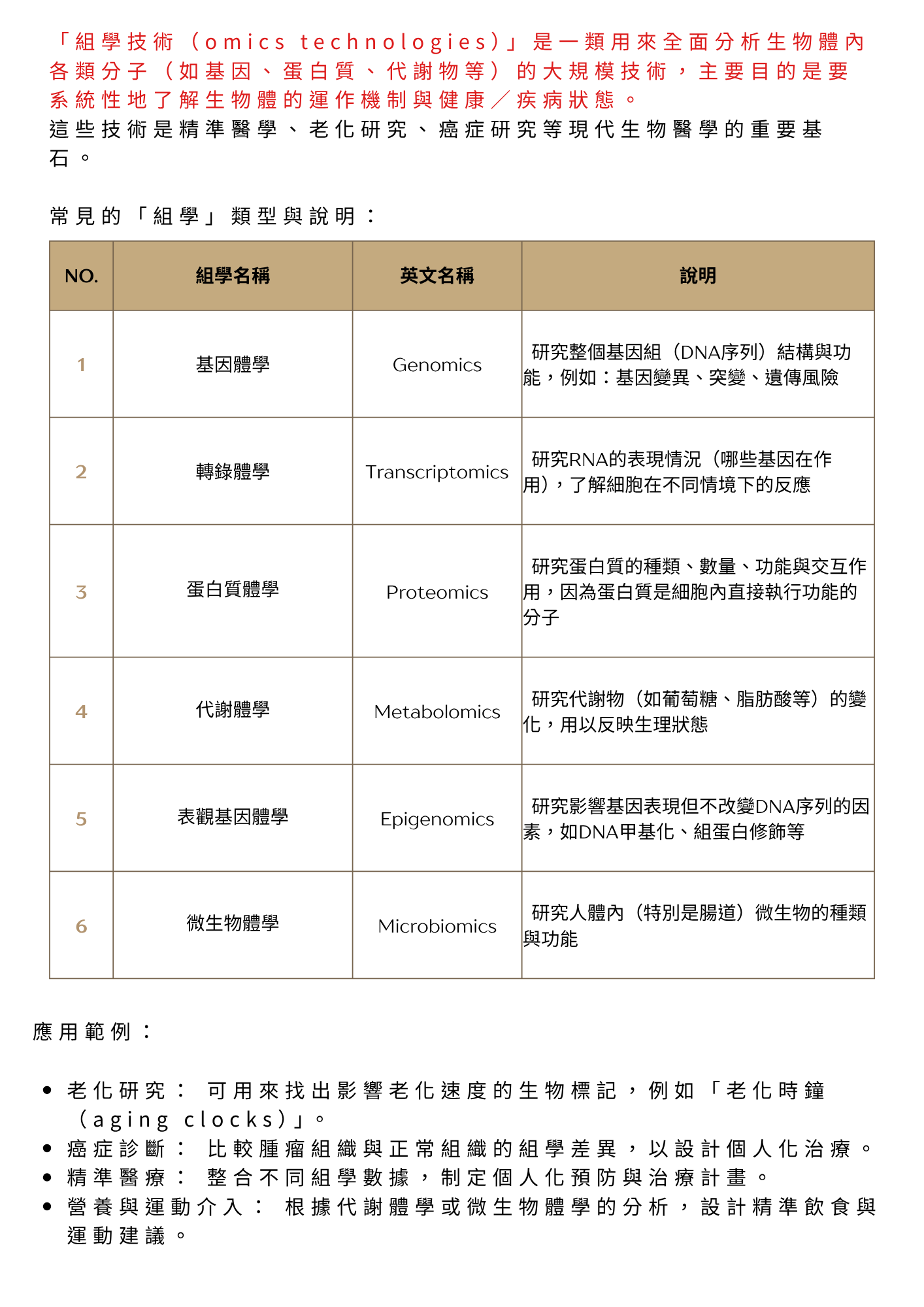
此方法的一大特色在於高度依賴系統性、高通量的「組學」技術(omics technologies),如基因體學、轉錄體學、蛋白質體學與代謝體學。
這些技術被用來量化生物樣本中的個體化分子特徵,特別評估那些被認為促進老化的因子(gerogenic factors)與抑制老化的因子(gerosuppressive factors)之表現或活性 [10]。此類分子圖譜的建立,可作為精準介入決策的依據。其中,「促老基因(gerogenes)」與「抑老因子(gerosuppression)」被明確定義為支撐此一精準醫學模型的兩大核心支柱,並與整體「精準醫療」的原則保持一致 [14]。
⚫ 老年科學與精準老化醫學的關係
這兩者的關係可視為「基礎研究 → 臨床應用」的進程:
- 老年科學(Geroscience):提供老化如何發生的基本科學理解。
- 精準老化醫學(Precision Geromedicine):則致力於將這些機制理解應用於個人化老化管理。
精準老化醫學可被視為老年科學的「下一階段演化」,得以實現的關鍵在於機制認識的深化(例如十四項老化標誌)與技術進步(如組學分析)。不同於老年科學強調跨人種或物種的共通老化機制,精準老化醫學則聚焦於個體間機制的差異性,並試圖運用這些差異為每個人打造專屬的健康策略。
「精準老化醫學(Precision Geromedicine)」這一新名詞的刻意命名與推廣,也透露出作者意圖將其與傳統「老年醫學(Geriatrics)」區隔開來的企圖。
- 傳統老年醫學著重於照護既有疾病、處理多重用藥、管理衰弱與協調長期照護等,是針對「已有病症」的處理。
- 相對地,精準老化醫學主張的是一種更前瞻、根本的介入策略,以分子層面的洞察為基礎,在功能衰退或疾病表現出現前就進行干預。
這種觀點重點從單純的「年齡」管理轉為強調「生理年齡(biological age)」的調控,著眼於老化過程中可被預測與逆轉的生物機制。
本論文特別強調,依賴組學技術 (omics technologies)來量化促老與抑老因子,是此策略是否成功的關鍵 [10]。因此,該領域亟需發展並臨床驗證一批可靠的「老化生物標記(biomarkers of aging)」:
- 可用來判斷個體老化軌跡與速度
- 作為臨床試驗中的替代指標
- 引導治療選擇與健康風險預測
這些「老年科學導向的生物標記(geroscience-guided biomarkers)」的發展與應用,不僅是實現精準老化醫學的最大挑戰,也是一大契機 [4]。
此外,強調使用組學技術 [10] 量化特定的促衰老(致衰老)和抗衰老(抑制衰老)分子,突顯了關鍵的依賴性。精準老年醫學的成功取決於可靠的生物老化生物標記的開發、驗證和臨床實施。
這些「老年科學指導的生物標記」不僅需要用於評估個人的衰老軌跡,而且可能作為臨床試驗的替代終點,指導治療選擇,並改進風險預測模型 [4]。因此,此類生物標記的開發和驗證是該領域面臨的核心挑戰和機會。
四、老化機制:從「老化標誌」的視角出發
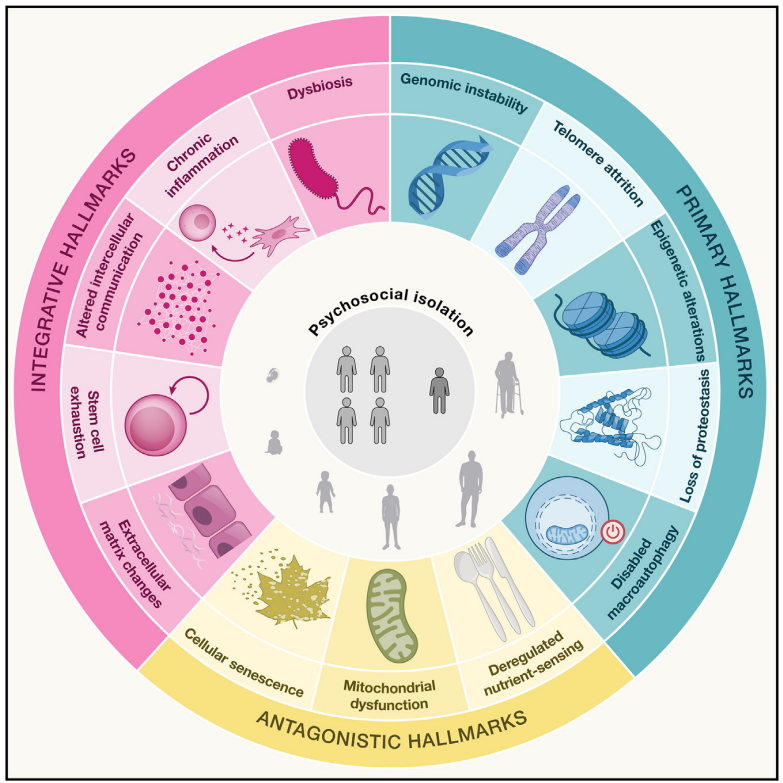
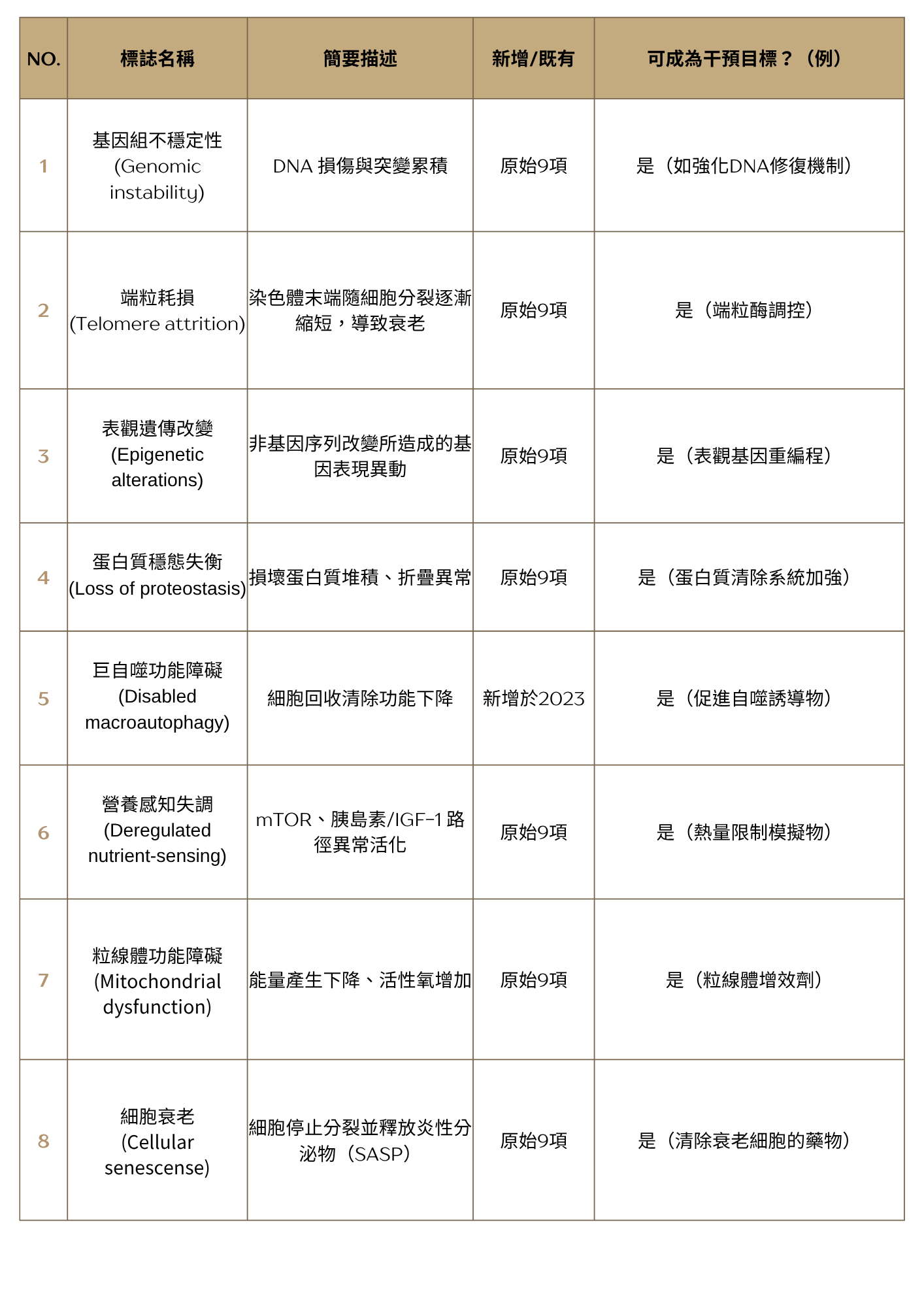
現代老年醫學科學的核心架構之一,即是由 Carlos López-Otín、Maria Blasco、Linda Partridge、Manuel Serrano 及 Guido Kroemer 於 2013 年在《Cell》共同提出的「老化標誌(Hallmarks of Aging)」框架 [13]。該理論首次有系統地將老化過程中的生物機制整理成一組可辨識、可研究的核心模組,揭示這些機制在不同生物間的共同性。2023 年,這一架構再次更新,由原本的九項擴增至十二項 [13]。
本論文進一步在此基礎上擴展與深化,提出總共十四項老化標誌 [12],為精準老化醫學的介入策略提供最新、完整的分子與細胞機制圖譜。這些標誌被定位為推動老化過程的關鍵生物因子,老年醫學科學與精準老化醫學的目標,即是辨識出其中「可操作」的標誌,進而進行有效干預 [7]。
以下是本論文提出的十四項老化標誌(hallmarks):
1. 基因組不穩定性:DNA 損傷與突變的累積。
2. 端粒縮短:隨細胞分裂而縮短的染色體末端,可能導致細胞功能障礙或進入衰老狀態。(在實證研究中,端粒長度與年齡的相關性在大規模人群中僅為弱相關 [34]。)
3. 表觀遺傳變化:並非由 DNA 序列改變所致的基因表達模式變化,會影響細胞功能。
4. 蛋白質穩態喪失:維持蛋白質穩定與預防受損蛋白質聚集的機制失效。
5. 巨胞自噬失能:細胞自我清除過程(自噬)受損,導致細胞廢物堆積。(此為 Kroemer 的研究專長之一 [17]。)
6. 營養感知調控失衡:感知營養供應並調節代謝與生長的路徑(如 mTOR、胰島素/IGF-1)異常。(mTOR 被視為促使細胞轉為衰老的驅動因子之一 [31]。)
7. 粒線體功能障礙:細胞能量產生效率下降,且產生活性氧自由基增加。(亦為 Kroemer 的核心研究領域之一 [15]。)
8. 細胞衰老:不可逆的細胞週期停滯狀態,常伴隨促發炎因子(SASP)分泌。(衰老細胞隨年齡累積,與多種老年疾病有關 [5]。)
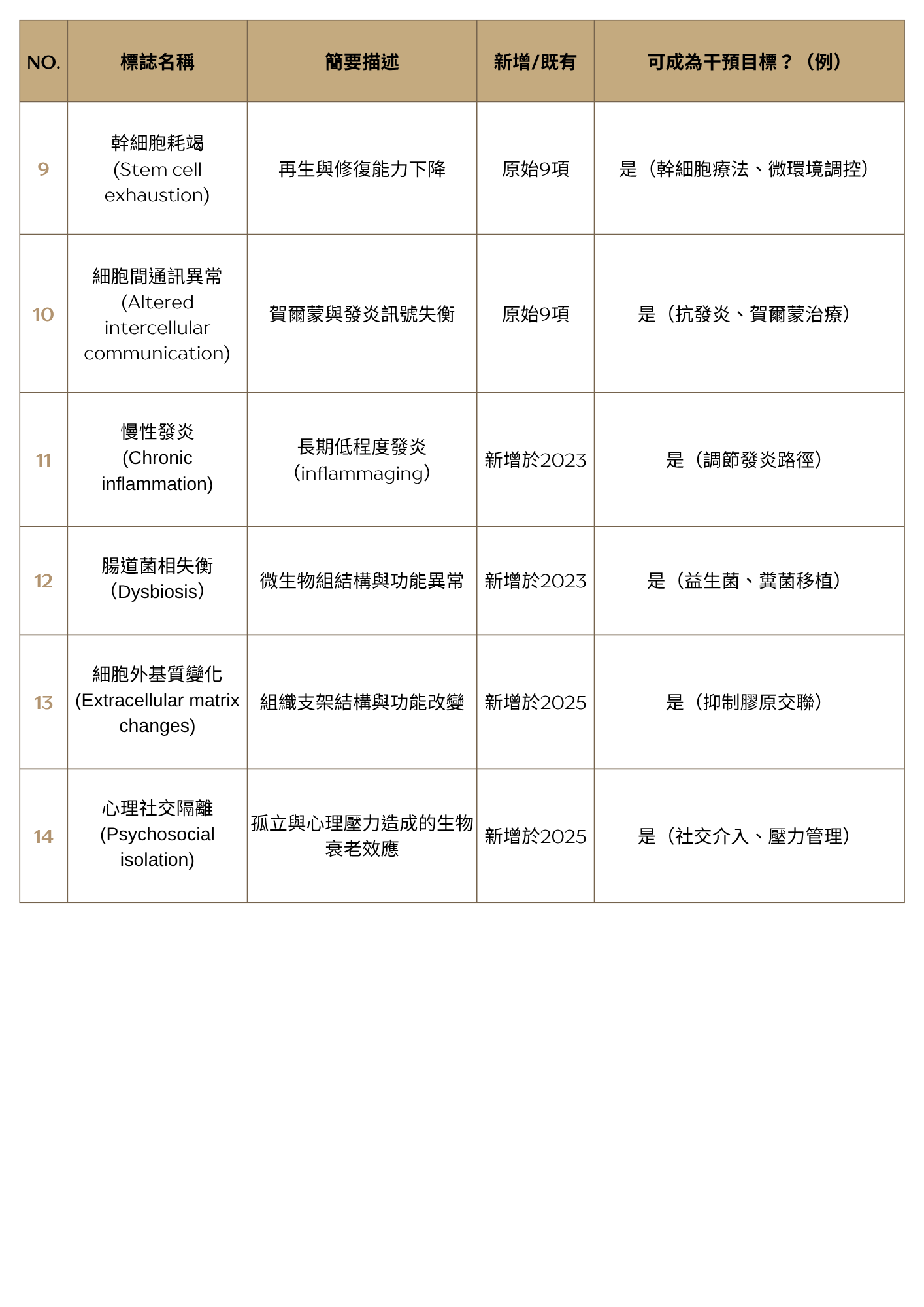
9. 幹細胞枯竭:幹細胞數量與功能的下降,削弱組織再生與修復能力。
10. 細胞間通訊異常:細胞間訊號傳遞變化,包括內分泌訊號與發炎反應增加(即「發炎性老化」)。
11. 慢性發炎:與老化相關的持續性、低度發炎狀態。
12. 菌相失衡:腸道菌群與其他微生物群落的組成與功能異常。(腸道菌群變化與虛弱症及其他老年相關狀況相關 [1],宿主與微生物的系統性交互作用會影響整體健康 [26]。)
13. 細胞外基質變化(2025年新增):組織中非細胞組成部分的改變,影響組織結構與功能。
14. 心理社會孤立(2025年新增):社會孤立與相關心理壓力對生物體造成的有害影響。(評論指出其與健康間有實證與經驗性關聯,心理社會壓力已被視為健康決定因子之一 [9]。)
新增的兩項老化標誌——「細胞外基質變化」,尤其是「心理社會孤立」——代表著老化生物學概念上的重大擴展[12]。過往的老化標誌主要集中於分子與細胞層級的事件,而這兩項則進一步將組織層級的結構以及社會與環境因素納入老化機制的基本架構中。
這顯示出老化研究正朝向更整體性的理解演進,認知到老化是受到多層次因素所影響,從基因與細胞,到組織結構與個體與其生活環境的互動 [26]。這種更宏觀的視角,有望將分子老化科學與公共衛生及心理社會研究領域相互連結,促進跨領域整合發展。
新增的兩項標誌——「細胞外基質變化」與尤其「心理社會孤立」——標誌著老化概念的重要擴展。過去的標誌主要聚焦於分子與細胞層級的事件,而這兩項則將組織結構與社會環境因素納入老化生物學的基本架構中。
這代表著老化研究正朝向更整體性的理解邁進,意識到老化受到多層次因素影響,從基因與細胞,到組織乃至個體與其所處的環境互動。此一更寬廣的視角有望將分子老化科學與公共衛生及心理社會研究領域相連結。
這些標誌的演進 —— 從九項到十二項,再到十四項 —— 體現出老化科學是一門高度動態、快速進展的領域 [13]。這也意味著精準老化醫學必須具備高度彈性,能隨著機制研究與新療法的進展,即時納入新的標誌與干預策略。
圖一:老化十四項標誌的概要示意圖及其在老化過程中於初級、對抗性與整合層級的作用 [7]
五、邁向介入實作:精準老化醫學的策略
本論文所闡述的核心目標,是將日益深入的老化生物學知識轉化為有效的干預措施。其提出的核心策略為「精準老化醫學(Precision Geromedicine)」,主張以個人化方式管理老化過程,預防或治療與老化相關的疾病 [10]。這種策略不同於「一體適用」的傳統方法,而是根據每位個體的生物老化特徵來量身打造介入方式。
此策略的關鍵賦能技術為系統性組學平台(omics technologies)[10]。這些技術涵蓋基因體學、轉錄體學、蛋白質體學、代謝體學、脂質體學等,能夠全方位量測生物樣本(如血液或組織)中數以千計的分子,進而產生個體當下生理狀態的高維度分子圖譜。
實現精準老化醫學的一個關鍵步驟,是透過「Gerogenes(促老基因)」與「Gerosuppressors(抑老因子)」的概念來解讀這些複雜的組學數據,提供功能性架構:
⚫ Gerogenes(促老基因):指的是那些在過度活化或失調時,會積極推動或加速生物老化過程的基因與分子路徑 [8]。例如:驅動慢性發炎、誘導細胞衰老的路徑,或是像 mTOR 這類營養感知機制在過度活化時也屬此類 [13]。此概念類比於癌症中的致癌基因(oncogenes)。
⚫ Gerosuppressors(抑老因子):包含能延緩、抑制或抵銷老化過程的基因、路徑、分子或介入方式[8]。如:強化 DNA 修復 [2]、提升自噬效率 [7]、維持蛋白穩態等。實證中的介入方式包括 mTOR 抑制劑雷帕黴素(rapamycin)[31]、天然化合物小蘗鹼(berberine,證實可抑制衰老轉換)[40],甚至在某些條件下的缺氧狀態 [37]。腎臟等器官亦可能具備抑老功能 [3]。
本論文指出,為了讓組學資料「可被行動化(actionable)」,需要透過分析工具「解卷」(deconvolute)這些數據,量化個體中促老與抑老因子的平衡與活性 [10]。此解析層次不僅是描述性的,更要賦予各分子角色(促老或抑老),進而聚焦於驅動或抑制老化的分子因子,為目標式介入提供依據。
根據個體化的分子評估,精準老化醫學的實踐目標包括:
- 預防(Prevention):識別具有加速老化或特定老年病高風險的分子特徵者,及早實施預防措施。
- 截斷(Interception):在臨床症狀出現前,偵測老化相關功能障礙的分子徵兆,及時介入以阻斷病程。
- 治療(Treatment):針對個體老年病的特定老化機制進行療法開發與應用。
- 最佳化(Optimization):透過分子數據引導生活方式(如飲食、運動 [28])與藥物介入,最大化健康壽命、身體韌性與整體健康狀態 [10]。
雖然本論文在策略層面尚未具體列出所有介入藥物,但可推知會對應已識別的老化標誌。潛在的介入類型包括:
- 去衰療法(Senolytics / Senomorphics):選擇性清除衰老細胞,或調節其有害分泌物(SASP)[5]。
- 自噬促進劑(Autophagy Enhancers):增強細胞清除機制的化合物 [17]。
- 代謝調節劑(Metabolic Modulators):針對營養感知路徑的藥物(如 mTOR 抑制劑雷帕黴素、AMPK 活化劑),或提升粒線體功能的藥物 [8]。
- 抗發炎劑(Anti-inflammatory Agents):針對慢性發炎的治療方案。
- 腸道菌相調節劑(Microbiome Modulators):例如益生元、益生菌或糞便微生物移植,重建健康的腸道菌相 [1]。
- 表觀遺傳調節劑(Epigenetic Modulators):可逆轉不良表觀遺傳變化的藥物。
- 生活型態介入(Lifestyle Interventions):個人化的飲食(如以植物性為主、避免加工食品 [39])、運動、壓力管理與睡眠建議,皆可由分子數據引導。
- 心理社會介入(Psychosocial Interventions):針對孤立與壓力的負面生物效應進行改善策略,呼應將心理社會因素納入老化標誌的概念 [39]。
要成功執行這一策略,極度依賴高階分析工具。將複雜、高維度的組學數據進行「解卷」[10],需仰賴先進的生物資訊學、計算生物學,甚至 AI 技術。這些工具需整合多種資料類型,建構促老與抑老因子之間的動態網絡,預測個體老化軌跡,並模擬可能介入方案的反應 [6]。
六、轉譯橋梁:從老年科學演進至精準老化醫學
本論文中明確指出,老年科學(geroscience)與精準老化醫學(precision geromedicine)之間的關係,是一種演化性的轉變 [10]。這標誌著該領域從單純強調基礎研究(理解老化的生理與分子機制)轉向強調如何將這些知識實際應用於個人健康管理。
⚫ 推動此轉變的關鍵因素包括
- 機制知識的累積:數十年的研究已大幅揭示老化的分子、細胞與生理基礎,並彙整於如「老化十四項標誌」這類的架構中,這些發現為介入策略提供了可行的目標 [7]。
- 科技進展:高通量組學技術的成熟與成本降低,使全面的分子資料蒐集成為可能 [10]。同時,老化生物標記的研發與驗證日益成熟,可將龐大的組學資料轉化為具臨床意義的指標 [4]。計算生物學與人工智慧的進展,也將加速資料分析與解釋 [41]。
- 概念框架的建立:如「老化標誌(Hallmarks of Aging)」與「促老基因/抑老因子(gerogene/gerosuppressor)」的雙元架構,為複雜生物資料的解釋與介入策略的設計提供了系統性理論支撐 [8]。
⚫ 此轉變對研究、臨床實務與整體醫療體系帶來深遠影響
1. 研究方向的重塑
未來研究將更聚焦於「轉譯研究(translational research)」,包括:
- 驗證老化生物標記在多元人群中的穩定性與適用性 [4] 。
- 設計並執行臨床試驗,專門測試針對老化機制的介入策略(即「老年科學介入」) [4] 。
- 開發針對老化標誌的新型療法。
- 重點強調:需彌合模式動物與人體應用之間的「轉譯鴻溝」,並納入種族、社經背景等因素,以確保應用公平性與普遍性 [6] 。
2. 臨床實務的重構
精準老化醫學描繪了未來臨床實務的新模式,將納入:
- 常規化的分子診斷程序(如組學分析、生物標記評估)。
- 根據個體老化機制,量身打造預防與治療策略。
- 超越目前以疾病為導向的被動醫療模式,轉向積極預防與個人化健康促進 [3] 。
此轉變可能要求醫師(如老年專科與基層照護醫師)重新定義其角色與專業能力,以能有效運用這些新興工具與方法 [1]。
3. 醫療體系的轉型需求
若能有效延長健康壽命並壓縮疾病時間,精準老化醫學將有望減輕老齡化社會所帶來的慢性病與醫療財政壓力 [5]。然而,此模式的實施,將對醫療體系提出重大挑戰,包括:
- 將高維度的組學數據整合進電子病歷與臨床決策支援系統
- 建立強固的資料隱私與資安保障架構
- 發展針對老年科學介入的新型監管機制
- 建立專業的實驗室與臨床診斷服務網絡
- 類比於細胞與基因治療所需的基礎設施,精準老化醫學同樣需配備複雜的個人化治療支援系統 [42]
老年科學與精準老化醫學之間的過渡,不僅是理論演化,更是未來醫療轉型的核心。若能克服資料整合、生物標記驗證、基礎建設與人才再培育等挑戰,這將不只是延緩老化的科研突破,而是帶動醫療從「疾病處理」走向「生理年齡管理」的全新典範。
⚫ 結論與未來展望
本論文的主要重點整理如下:
- 老年科學奠定基礎:數十年的基礎研究已深刻揭示老化的分子、細胞與跨細胞層級機制,構成老年科學(geroscience)的核心成果 [7]。
- 精準老化醫學的興起:這些進展促使臨床實務朝向新的典範——精準老化醫學(precision geromedicine)轉變,將老年科學應用於個人化健康管理 [10]。
- 組學技術為關鍵工具:精準老化醫學倚賴高通量組學技術,以量化個體分子的老化圖譜,評估促老(gerogenic)與抑老(gerosuppressive)因子的平衡 [10]。
- 個人化管理為終極目標:根據個體的分子資訊,制定預防、阻截與治療老年病的策略,以最大化健康壽命與身體韌性。[10]
- 老化標誌架構更新:提出的十四項老化標誌,提供更完整的生物老化圖譜,亦為干預目標指引 [12]。
- 促老與抑老概念為核心支柱:gerogenes 與 gerosuppressors 概念被視為解析分子資料、設計介入策略的核心理論支柱 [14]。
⚫ 未來展望與挑戰
- 生物標記驗證:需開發並嚴格驗證一批可反映生理年齡與老化標誌狀態的生物標記,適用於多元人群,用於診斷、預後與治療評估 [4]。
- 臨床轉譯推進:須投入大量研究,以橋接從模式生物到人體應用的落差,特別是針對老年科學介入設計大規模臨床試驗,檢驗其延緩老化與治療老年病的有效性與安全性 [4]。
- 資料解析工具:組學資料龐大複雜,亟需先進的生物資訊與人工智慧工具協助資料整合、預測與解釋[6]。
- 整合與全人觀點:未來策略應整合分子資料與臨床評估、表現型資料與心理社會因素,真正實現全人健康管理。「心理社會孤立」被納入老化標誌,即反映此跨域整合趨勢 [12]。
- 倫理、法律與社會議題(ELSI):精準老化醫學涉及公平性、資料隱私、資源分配與社會對老化與延緩老化觀念的接受程度等問題 [6]。
- 政策與資金支持:持續且策略性地投入公私部門資源,以支持老年科學研究與臨床應用,是推動發展的關鍵 [6]。
⚫總結
Guido Kroemer 團隊於《Cell》期刊發表的〈從老年科學到精準老化醫學:理解與管理老化〉一文,提出一個極具前瞻性的未來藍圖,將老化研究推向臨床應用的新紀元。該文在整合過去對老化生物機制的深入認識基礎上,明確規劃了將此知識轉譯為個人化醫療實踐的未來方向。
本文不僅鞏固並擴充了具有高度影響力的「老化標誌」架構,更提出十四項核心機制,包括對「細胞外基質」與「心理社會孤立」等新興老化機制的納入,反映出老化觀點正朝向更整體、更人本的方向發展。
本論文的核心在於:
- 借助先進的組學技術建立個體化分子圖譜,
- 透過「促老基因」與「抑老因子」的功能性視角解析資料,
- 擬定主動式預防、截斷與治療老年病的個人化策略,
- 並最終優化健康壽命與老年韌性。
這項論述代表了醫學觀念的重大轉變——不再是被動治療老年疾病,而是主動管理老化過程本身。
儘管其對個人健康與公共衛生的潛在效益可觀,但真正落實精準老化醫學仍面臨重重挑戰,包括:
- 生物標記的驗證難度
- 從基礎研究邁入臨床應用的轉譯落差
- 資料處理的技術門檻
- 多層次資料整合的複雜性
- 以及倫理與法規層面的落實障礙等
這篇論文,既是老年科學成果的總結,也是未來老化醫學發展的行動路線圖。它形塑了「精準老化醫學」的概念與語言,極可能成為未來研究、政策制定與臨床創新的關鍵參考,為人類延展健康壽命與改善老年生活品質指引方向。
參考文獻
- https://www.researchgate.net/publication/390887889_From_geroscience_to_precision_geromedicine_Understanding_and_managing_aging
- https://www.researchgate.net/publication/351308828_Whole-genome_sequencing_analysis_of_semi-supercentenarians
- https://academic.oup.com/ndt/advance-article-pdf/doi/10.1093/ndt/gfaf068/62907942/gfaf068.pdf
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8901559/
- https://system.umn.edu/dearmn/geroscience-research-may-hold-key-healthy-aging
- https://www.afar.org/amplifying-geroscience-initiative
- https://www.cell.com/cell/fulltext/S0092-8674(25)00284-3
- https://aging.biopolaris.com/
- https://news.qq.com/rain/a/20250420A05GT700
- https://www.journaltocs.ac.uk/index.php?action=tocs&journalID=2154
- https://genescells.ru/0929-8673/article/statistics/644632
- https://news.qq.com/rain/a/20250421A044OA00
- https://news.bioon.com/article/66588e30279a.html
- https://pubmed.ncbi.nlm.nih.gov/38802575/
- https://pubmed.ncbi.nlm.nih.gov/26374520/
- https://scispace.com/authors/guido-kroemer-29mmefvtel
- https://longevitymedsummit.com/guido-kroemer/
- https://www.eurekalert.org/news-releases/980576
- https://pubmed.ncbi.nlm.nih.gov/35145297/
- https://pubmed.ncbi.nlm.nih.gov/32253221/
- https://orcid.org/0000-0002-9334-4405
- https://pubmed.ncbi.nlm.nih.gov/29476153/
- https://pubmed.ncbi.nlm.nih.gov/36599349/
- https://www.oeaw.ac.at/en/m/kroemer-guido
- https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.0050206
- https://pubmed.ncbi.nlm.nih.gov/36658422/
- https://sciprofiles.com/profile/12077
- https://portalinvestigacion.uniovi.es/investigadores/217776/colaboracion/investigador/3063025
- https://biotech-spain.com/en/articles/-the-spectacular-progress-in-research-into-slowing-down-aging-analyzed-in-cell-by-maria-a-blasco-and-other-leading-researchers-in-the-field/
- https://www.researchgate.net/scientific-contributions/Guido-Kroemer-2119307951
- https://www.tandfonline.com/doi/full/10.4161/15384101.2014.985507
- https://pubmed.ncbi.nlm.nih.gov/38181790/
- https://www.scitechnol.com/editor-profile/Guido_Kroemer/
- https://www.researchgate.net/publication/373036175_Telomere_length_and_chronological_age_across_the_human_lifespan_a_systematic_review_and_meta-analysis_of_414_study_samples_including_743019_individuals
- https://www.aging-us.com/article/204543/text
- https://www.researchgate.net/publication/269284822_Geroconversion_Irreversible_step_to_cellular_senescence
- https://pmc.ncbi.nlm.nih.gov/articles/PMC3421205/
- https://pmc.ncbi.nlm.nih.gov/articles/PMC5748990/
- https://www.researchgate.net/publication/378898187_The_missing_hallmark_of_health_psychosocial_adaptation
- https://www.researchgate.net/publication/256101165_Berberine_suppresses_gero-conversion_from_cell_cycle_arrest_to_senescence
- https://www.aging-us.com/article/203859/text
- https://www.precisionformedicine.com/clinical-development-strategy/cell-gene-therapy-strategies