www.joiiup.com
防治慢性病從提升粒線體功能開始:光生物調節療法的巨大潛力
粒線體負責我們大部分的細胞能量需求,因此,粒線體功能障礙會導致疲勞和各種症狀,這些症狀通常出現在慢性疾病中。當失去內部粒線體膜跨膜電位(Mitochondria Membrane Potential; MMP)的維持、電子運輸鏈的調整、粒線體DNA (mtDNA)損傷、粒線體轉錄改變以及運輸至粒線體的關鍵酶基(substrate)和代謝物減少時,粒線體功能就會下降。
近期的醫學研究文獻已經紛紛證實諸多現代社會的重大慢性病與粒線體功能障礙息息相關,包含癌症、心血管疾病、阿茲海默症、憂鬱症…等等

粒線體功能障礙與癌症
細胞能量的管控鬆弛(Deregulation)是癌症的標誌之一。細胞能量學失調的幾種潛在機制與由mtDNA突變、粒線體酶缺陷或致癌基因/腫瘤抑制因子改變所引起的粒線體功能障礙有關。
Hsu及其團隊在研究中[1]總結了有關粒線體功能障礙在癌症進展中作用的最新見解。點突變和複製數變化是癌症中最常見的兩種mtDNA改變,癌細胞中mtDNA的化學耗竭或粒線體呼吸鏈受損引起的粒線體功能障礙會促使癌症發展為化學耐藥性或侵襲性表型。
此外,粒線體酶的缺陷與家族性和散發性癌症有關。粒線體脫乙酰基酶sirtuin 3失調可能透過調節細胞代謝和氧化壓力來影響癌症的進展。這些在腫瘤發生和腫瘤進展過程中的粒線體缺陷激發了細胞質信號轉導通路,最終改變了核基因的表達,這一過程稱為逆行信號轉導。細胞內ROS、Ca2 +或代謝產物水平的變化在粒線體逆行信號中對於腫瘤轉化和癌症進展很重要。此外,改變的癌基因/腫瘤抑制因子(包括缺氧誘導因子1和腫瘤抑制因子p53)通過調節靶基因的表達來調節粒線體呼吸和細胞代謝。因此,研究團隊認為粒線體功能障礙在癌症進展中起了關鍵作用。
Guerra F的研究團隊指出大多數癌細胞在mtDNA中具有體細胞突變或mtDNA含量發生變化,從而導致粒線體功能障礙[2]。在啟動腫瘤的細胞中也檢測到mtDNA含量降低,這是癌細胞的一個亞群,據信在化療後的癌症復發中扮演了關鍵角色。儘管粒線體基因的突變在癌細胞中很常見,但它們並不能完全關閉粒線體能量代謝和功能。相反,它們透過“功能失調”的粒線體激發粒線體至細胞核的信號傳導,促進癌細胞的生物能學和生物合成譜圖的重新連接,從而導致癌症相關基因和信號通路的轉錄或活性發生變化。
Moro L最近的論文[3]表明,衰老是癌症發展的主要風險因素,這表明這兩件事可能代表一枚硬幣的兩個面。越來越明顯的是,透過聚集或發散途徑,衰老過程中涉及的某些機制是與腫瘤發生共通的。越來越多的證據顯示粒線體功能障礙在促使衰老、腫瘤發生和癌症發展為轉移表型方面的角色。
粒線體功能障礙與阿茲海默症

阿茲海默症是一種常見的腦部神經破壞性疾病,其特徵在於Aβ肽聚集。但是,我們對潛在的分子機制或如何治療阿茲海默症知之甚少。Vincenzo Sorrentino及其研究團隊提供了在人類、小鼠和秀麗隱桿線蟲的Aβ蛋白毒性的疾病中存在的保守粒線體壓力反應特徵的生物信息學和實驗證據[4],該疾病與粒線體展開的蛋白質反應和粒線體自噬途徑有關。
使用Aβ蛋白毒性蠕蟲模型GMC101,團隊概述了粒線體特徵,並證實誘導這種粒線體壓力反應對於維持粒線體蛋白穩態和健康至關重要。研究的數據支持增強粒線體蛋白穩態與延緩Aβ蛋白毒性疾病(例如阿茲海默症)的相關性。
Akhter F及其團隊的研究有明顯證據表明[5],與年齡有關的阿茲海默症和糖尿病主要與粒線體功能障礙有關。粒線體缺陷導致活性氧(ROS)產生增加,蛋白質間相互作用異常以及粒線體ATP產生減少。伴隨著粒線體功能受損的ROS和粒線體通透性轉換孔洞(mitochondrial permeability transition pore; mPTP)形成的過度產生對神經元擾動起重要作用。其他一些因素,包括細胞內Ca2 +,Aβ和親環蛋白D (cyclophilin D; CypD)在mPTP形成中也都導致粒線體功能障礙。此外,改變的粒線體融合和裂變事件對粒線體動態的破壞會導致粒線體和突觸損傷以及與阿茲海默症和糖尿病的發病機制有關的認知能力下降。
與阿茲海默症相關的神經病理學標誌物(amyloid precursor protein (APP),Aβ和τ)和遺傳危險因素(sporadic AD risk genes ; APOE)已顯示與粒線體功能相互作用並改變粒線體功能。也有證據支持粒線體功能異常本身可能觸發神經退行性變和異常的APP或τ處理的觀點[6]。
粒線體功能障礙與心血管疾病
心血管疾病(CVD)是全球主要的死亡原因。包括心臟在內的高能量需求的組織和器官中,適當的粒線體功能是必需的。
粒線體對養分和氧氣供應非常敏感,並能對不斷變化的環境進行代謝適應。在CVD中,這種適應性受損,繼而導致呼吸鏈和ATP合成異常等粒線體功能逐漸下降,氧化壓力增加以及粒線體結構完整性喪失。
有功能障礙的粒線體中,電子傳輸鏈的解偶聯,導致活性氧產生的增加、細胞ATP能量池的耗竭、大量的細胞損傷和心肌細胞凋亡。粒線體吞噬是一個過程,在此過程中,細胞會利用自噬機制將自身從功能異常和受損的粒線體中清除。Cheng及其研究團隊表明粒線體質子洩漏在心血管疾病的發病機制中起關鍵作用[7]。粒線體質子洩漏是基酶氧與ATP生成不完全耦合的主要機制。質子傳導大多數是由位於粒線體內膜上的解偶聯蛋白(uncoupling proteins ; UCP)介導的。顯然,粒線體中的電子傳輸鏈(ETC)產生的質子洩漏和ROS相互關聯。越來越多的證據表明,質子洩漏和UPC在心血管疾病的發病機制中起著至關重要的作用。
粒線體功能障礙的積累使心臟衰竭過程中的放鬆調控情況更加不利。在心臟病理學中,呼吸鏈活性和ATP產生的異常可能被認為是粒線體功能障礙的核心。實際上,可以將這些關鍵功能特性的治療性恢復視為改善CVD中粒線體功能障礙的主要目標。粒線體功能障礙在心血管疾病的發病機制中起著至關重要的作用。心血管疾病與粒線體生物生成和清除改變有關。在心血管疾病中,粒線體功能受損會導致ATP生成減少和ROS形成增加。[8,9]
粒線體功能障礙與憂鬱症[10,11,12]
憂鬱症是最使人衰弱的神經精神疾病,對個人的社會職業和幸福感有嚴重的負面影響。儘管提出了各種理論,但憂鬱症的確切病理生理學仍是個謎。有證據表明,各個大腦區域的粒線體功能障礙與憂鬱症有關。最近的發現激發人們重新認識到粒線體在許多細胞內過程中的作用,這些過程與突觸可塑性和細胞彈性有關。憂鬱症病理生理學的新見解圍繞著神經可塑性的損害。粒線體在ATP產生,細胞內Ca2 +信號傳導中具有具體作用,以建立細胞膜穩定性,ROS平衡並執行神經傳遞和可塑性的複雜過程。因此,了解憂鬱症發病機制中的粒線體功能障礙的各種概念,有助於產生新穎且更具針對性的憂鬱症治療方法。
Bansal Y及其團隊的研究[10]結果發現粒線體功能障礙在憂鬱中的作用。粒線體功能受損會導致各種負面效應產生,從而加劇憂鬱症的發病機制(如圖一)。針對粒線體功能障礙和增強粒線體功能是治療憂鬱症極有潛力的目標。
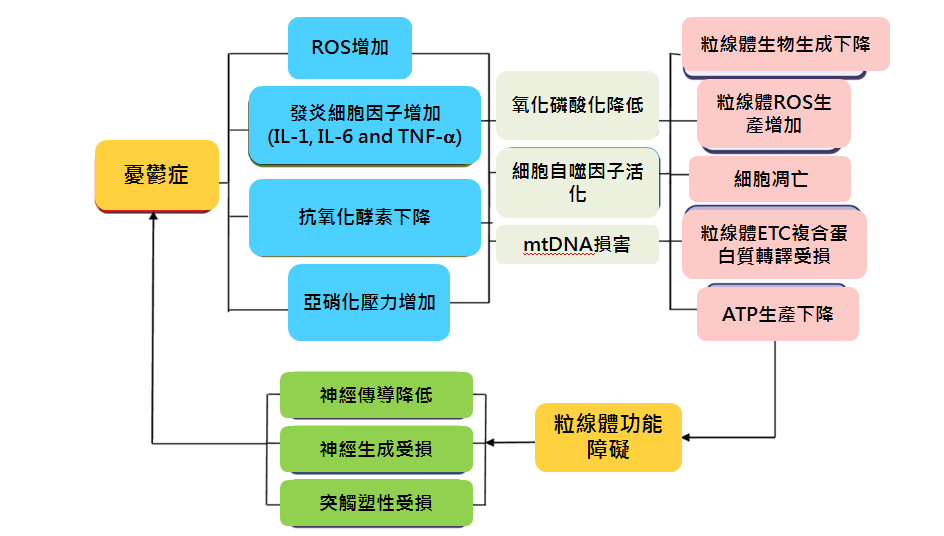 圖一:暴露於不同的壓力情況下會導致ROS產生增加,促炎細胞因子水平增加,亞硝化壓力增加和抗氧化酶水平降低,最終導致氧化磷酸化(OXPHOS)降低,凋亡途徑活化並導致mtDNA損傷,從而導致粒線體生物生成減少、 ROS產生增加、神經元細胞凋亡、粒線體ETC複合蛋白的翻譯受損以及ATP產生減少,導致粒線體功能障礙。神經生成、突觸可塑性和神經元傳遞、能適應壓力條件的重要參數也因粒線體功能障礙而受損,因此在嚴重憂鬱症中也起著重要作用。[10]
圖一:暴露於不同的壓力情況下會導致ROS產生增加,促炎細胞因子水平增加,亞硝化壓力增加和抗氧化酶水平降低,最終導致氧化磷酸化(OXPHOS)降低,凋亡途徑活化並導致mtDNA損傷,從而導致粒線體生物生成減少、 ROS產生增加、神經元細胞凋亡、粒線體ETC複合蛋白的翻譯受損以及ATP產生減少,導致粒線體功能障礙。神經生成、突觸可塑性和神經元傳遞、能適應壓力條件的重要參數也因粒線體功能障礙而受損,因此在嚴重憂鬱症中也起著重要作用。[10]
LLLT與粒線體功能
LLLT對粒線體功能的提升的相關醫學研究非常豐富與完整。LLLT也稱為光生物調節(PhotoBioModulation; PBM),是將低功率雷射或發光二極體(LED)應用於人體以達到治療目的。
對LLLT與粒線體作用機制研究最深入的重點就是細胞色素c氧化酶(cytochrome c oxidase ; CCO),它是粒線體呼吸鏈的第四個單元(如圖二),負責利用葡萄糖代謝所產生的電子將氧氣還原為水[13]。從理論上講,一氧化氮(NO)可能會抑制CCO酶的活性(尤其是在缺氧或受損的細胞中)。這種具抑制性的NO可以被CCO(包含兩個血紅素和兩個擁有不同吸收光譜的銅中心CuA和CuB)所吸收的光子從CCO解離[14]。這些吸收峰主要在紅色(600-700 nm)和近紅外線(760-940 nm)光譜區域。當NO被光離解釋放出時,粒線體膜電位會增加,使更多的氧氣被消耗、更多葡萄糖被代謝,而粒線體會產生更多的ATP。LLLT療法也被證實可提高肌管中的粒線體膜電位(MMP)和ATP合成[15]。
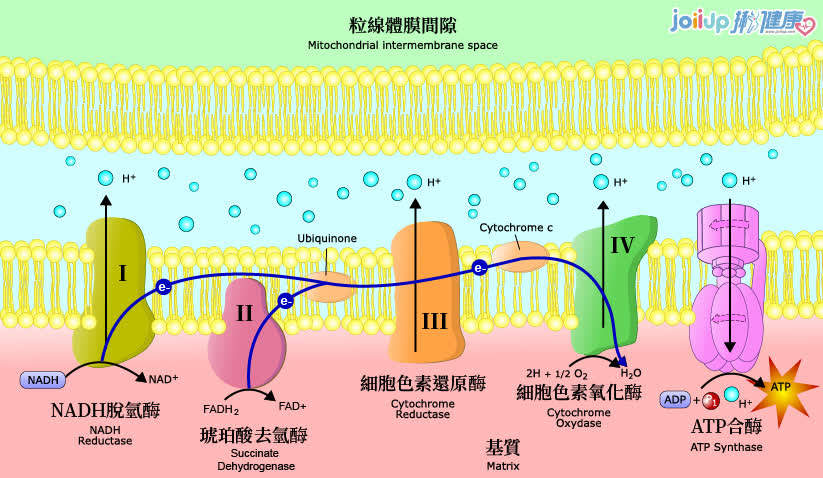
圖二:粒線體內的電子傳遞鏈(呼吸鏈)第四個單元就是細胞色素氧化酶
代謝功能改善是LLLT最容易被察覺的作用之一,而增加的細胞內ATP產生則是最受支持的作用機制之一[16]。此外,一些臨床前研究表明,由於各種腦部疾病,接受LLLT的實驗動物(小鼠或大鼠)的大腦ATP含量明顯增加了[17, 18]。普遍認為粒線體功能障礙、ATP供應不足和氧化壓力是幾乎所有形式的腦疾病的促成因素[19]。據研究報導,這涉及神經系統疾病,例如重度憂鬱症、腦外傷、帕金森氏病和AD [20~23]。
研究顯示當粒線體吸收LLLT期間傳遞的光子時,粒線體中產生的活性氧(ROS)會瞬間增加。ROS的爆發可能觸發粒線體信號傳導途徑,從而導致細胞中的細胞保護、抗氧化和抗凋亡(anti-apoptotic)作用[24]。通過光解離作用釋放的NO既可作為血管擴張劑,也可作為淋巴液的擴張劑。此外,NO也是有效的信號分子,可以激發許多有益的細胞途徑[25],圖三說明了這些機制。

圖三:LLLT的分子和細胞內機制。 AP1(激發蛋白1)、 ATP(三磷酸腺苷)、 Ca2+(鈣離子)、cAMP(環狀單磷酸腺苷)、NF-kB(核因子κB)、NO(一氧化氮)、ROS(活性氧)、TRPV(瞬態感受器電位陽離子通道)。(圖片內容來源:M.R. Hamblin / BBA Clinical 6 (2016) 113–124,JoiiUp 重新製圖)
Wang及其團隊最近(2019/11月)剛剛發表[26]針對全腦缺血(Global Cerebral Ischemia; GCI)的光生物調節:靶向粒線體動態和功能。表明光生物調節(PBM)治療這種非侵入性治療方式已經成為潛在的新型腦損傷治療方法。在這項研究中,團隊評估了GCI後6小時開始PBM (808 nm LED)治療的療效。值得注意的是,在脆弱的海馬迴CA1亞區,與劑量相關的PBM保護GCI誘導的神經元免於死亡。功能評估表明,GCI後PBM顯著保留了短期(一周)和長期(6個月)的空間學習和記憶功能。進一步的機制研究表明,PBM治療後(a)通過降低有害的Drp1 GTPase活性及其與銜接子蛋白Mff和Fis1的相互作用以及平衡粒線體靶向裂變和融合蛋白的作用,保留了健康的粒線體動態並抑制了CA1神經元的實質性粒線體斷裂水平; (b)減少粒線體的氧化損傷和過多的粒線體自我吞噬,並恢復粒線體的整體健康狀況並保持粒線體功能;(c)抑制粒線體依賴凋亡小體的形成/ caspase-3 / 9凋亡處理的活性。此外,研究團隊在體外缺血模型中驗證了CCO是PBM對於粒線體功能保存和神經保護的關鍵。因此PBM可作為GCI後功能恢復的有前景的治療策略,其機制涉及PBM對粒線體動態和功能的保護以及對GCI延遲性凋亡神經元死亡的抑制。
此外,Chang及其團隊也於2019/9月發表於Nature雜誌表明光生物調節已被建議對包括見大黴素(GM)在內的氨基糖苷類藥物(aminoglycosides)引起的不可逆性聽力損失具有治療作用[27]。在此研究中,研究團隊調查了PBM在GM誘導的聽覺細胞耳毒性中的作用,描繪通過PBM下游過程的特徵,該過程觸發了聽覺細胞的細胞活力提升。結果證實了PBM藉由增加ATP水平和粒線體膜電位對GM誘導的耳毒性的作用。
結論
東方的醫學一直著重於氣,所謂氣血平衡,百病不侵。而近代西方醫學針對與老化相關的慢性疾病則有極大的研究重心放在細胞的能量發電廠-粒線體的功能障礙。事實上,已有太多的研究證據顯示,這些棘手的慢性病幾乎與粒線體功能障礙脫離不了關係。研究表明,在波長632~1064奈米(nm)之間的紅光和近紅外線會產生積極的生物學效果。這些光會刺激細胞內的光化學反應,從而加速自然癒合過程並引起行為的有益變化。它是如何做到的?主要是透過活化你的粒線體並產生更多的ATP。因此我可以大膽假設,LLLT在未來與粒線體功能障礙相關的慢性病防治及治療上將扮演極為重要的角色。
衍伸閱讀
經顱光生物調節tLLLT治療對大腦的好處/陳風河博士
低能量光療(LLLT)對腦部疾病的機制/陳風河博士
紅光低能量光療法(LLLT)對健康的驚人好處/陳風河博士
高強度間歇訓練(HIIT)有助改善你的粒線體健康/陳風河博士
參考文獻
[1] https://www.ncbi.nlm.nih.gov/pubmed/31731601
[2] https://www.ncbi.nlm.nih.gov/pubmed/28161329
[3] https://www.ncbi.nlm.nih.gov/pubmed/31731601
[4] https://www.nature.com/articles/nature25143
[5] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5896572/
[6] https://www.ncbi.nlm.nih.gov/pubmed/30675901
[7] https://www.ncbi.nlm.nih.gov/pubmed/28551798
[8] https://www.ncbi.nlm.nih.gov/pubmed/29237304
[9] Gian Paolo Fadini, Age-associated cardiovascular risk and metabolomics of mitochondrial dysfunction, Atherosclerosis, February 2014, Volume 232, Issue 2, Pages 257–258
[10] https://www.ncbi.nlm.nih.gov/pubmed/26923778
[11] https://www.ncbi.nlm.nih.gov/pubmed/28669580
[12] https://www.ncbi.nlm.nih.gov/pubmed/26926143
[13] L.F. De Freitas, M.R. Hamblin, Proposed mechanisms of photobiomodulation or low-level light therapy, IEEE J. Sel. Top. Quantum Electron. 22 (2016) 7000417.
[14] N. Lane, Cell biology: power games, Nature 443 (2006) 901–903.
[15] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4355185/
[16] Mintzopoulos D, Gillis TE, Tedford CE, Kaufman MJ, Effects of Near-Infrared Light on Cerebral Bioenergetics Measured with Phosphorus Magnetic Resonance Spectroscopy. Photomed. Laser Surg 2017, 35, 395–400.
[17] Ando T et al., Comparison of Therapeutic Effects between Pulsed and Continuous Wave 810-nm Wavelength Laser Irradiation for Traumatic Brain Injury in Mice. PLoS ONE 2011, 6, e26212–e26220.
[18] Salehpour F et al., Transcranial low-level laser therapy improves brain mitochondrial function and cognitive impairment in D-galactose–induced aging mice. Neurobiol. Aging 2017, 58, 140–150.
[19] Kann O, The interneuron energy hypothesis: Implications for brain disease. Neurobiol. Dis 2016, 90, 75–85.
[20] Cao X et al., Astrocyte-derived ATP modulates depressive-like behaviors. Nat. Med 2013, 19, 773–777.
[21] Lyons DN et al., A Mild Traumatic Brain Injury in Mice Produces Lasting Deficits in Brain Metabolism. J. Neurotrauma 2018, 35, 2435–2447.
[22] Briston T; Hicks AR, Mitochondrial dysfunction and neurodegenerative proteinopathies: Mechanisms and prospects for therapeutic intervention. Biochem. Soc. Trans 2018, 46, 829–842.
[23] Swerdlow RH, Burns JM, Khan SM, The Alzheimer’s disease mitochondrial cascade hypothesis: Progress and perspectives. Biochim. Biophys. Acta 2014, 1842, 1219–1231.
[24] G.B. Waypa, K.A. Smith, P.T. Schumacker, O2 sensing, mitochondria and ROS signaling: the fog is lifting, Mol. Asp. Med. 47-48 (2016) 76–89.
[25] Y. Zhao, P.M. Vanhoutte, S.W. Leung, Vascular nitric oxide: beyond eNOS, J. Pharmacol. Sci. 129 (2015) 83–94.
[26] https://www.ncbi.nlm.nih.gov/pubmed/29951942
[27] https://www.nature.com/articles/s41598-019-55711-9.pdf?origin=ppub











